اصول خوردگی
مبانی سلهای الکتریکی – ویژگی یک واکنش شیمیایی در این واقعیت پنهان است که انجام آن همراه با گرفتن و یا دادن الکترون همراه است. این نوع واکنش را به صورت زیر نشان می دهند.
اصول خوردگی

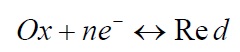
که در آن Red عامل کاهنده (دهنده الکترون) و OX عامل اکسنده (دریافت کننده الکترون). و n تعداد الکترون های (-e) شرکت کننده در واکنش است.
یک عامل کاهنده و یک عامل اکسنده را که طبق واکنش بالا به هم ربط پیدا می کنند. اغلب زوج اکسایش – کاهش و واکنش را واکنش اکسایش-کاهش می نامند.
در یک محلول، الکترون به صورت آزاد وجود ندارند، لذا الکترون های که منتشر می شوند. در یک واکنش اکسایش باید همزمان با انجام یک واکنش کاهش به مصرف برسد.
یک راه حل ممکن برای این منظور آن است که تماس بین واکنش اکسنده و کاهنده. که هر دو در محلول وجود دارند انجام گیرد، برای مثال:
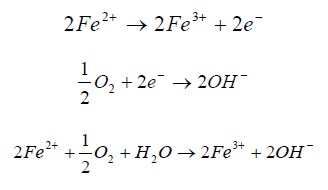
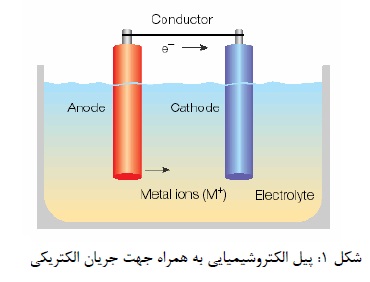
راه دیگر، انجام واکنش در یک پیل الکتروشیمیایی مطابق (شکل1) است. یک پیل الکتروشیمیایی از نوع معمولی شامل دو الکترود است که توسط الکترولیت با هم در ارتباط هستند. الکترودها از جنس رسانای الکترون درست می شوند. مانند یک فلز که در تماس با یک الکترولیت است. الکترولیت اغلب یک محلول آبی است که قادر به رسانش الکتریسیته است. از ویژگی الکترولیت این است که جریان در داخل آن به وسیله یونها انتقال می یابند. الکترودی که از آن جریان الکتریسیته مثبت وارد الکترولیت می شود. آند و الکترودی که از آن، جریان الکتریسیته، الکترولیت را به سمت الکترود ترک می کند کاتد نام دارند.
عبور جریان الکتریسیته از سطح یک الکترود در یک جهت یا در جهت دیگر همواره با یک واکنش الکتروشیمیایی همراه است. که آن را در یک واکنش الکترودی می نامند. واکنش الکترود در آند یا واکنش آندی همواره یک واکنش اکسایش است و واکنش کاتدی همواره یک واکنش کاهش می باشد.
یک پیل الکتروشیمیایی که در آن عبور جریان به کمک نیروی یک منبع خارجی صورت می گیرد، پیل الکترولیتی نام دارند. یک پیل الکتروشیمیایی را که خود جریان الکتریکی را تولید می کند را پیل گالوانیکی می نامند.
قانوان فارادی
نتیجه ورود جریان به الکترولیت خروج آن از الکترولیت همواره با واکنش های الکترودی همراه است. که به صورت تغییراتی در سازنده های الکترود یا محیط اطراف الکترود ظاهر می شوند. کمیت های تبدیل شده در طی واکنش های الکترودی متناسب است با مقدار جریانی که از سطح الکترود عبور می کند. و این پدیده بر طبق فاردای تعریف می شود. بر طق این قانون، برای تبدیل یک مول الکترون (-e) ، 96500 کولن (آمپر ثانیه) یا 26/8 (آمپر-ساعت) الکتریسیته لازم است.
بازدهی جریان برای یک واکنش الکترودی معین بخشی ا جریان است که برای انجام واکنش در سطح الکترود لازم است. مابقی جریان توسط واکنش های دیگر الکترودی مصرف می شود که به طور همزمان در سطح الکترود دیگر انجام می گیرد.
قطبش
هرگاه یک قطعه فلز Me. در داخل محلول آبی حاوی یون های فلزMe +n قرار داشته باشد. در این صورت، واکنش الکترودی در سطح الکترود صورت می گیرد و آن قدر ادامه می یابد تا به تعادل برسد:
اصول خوردگی
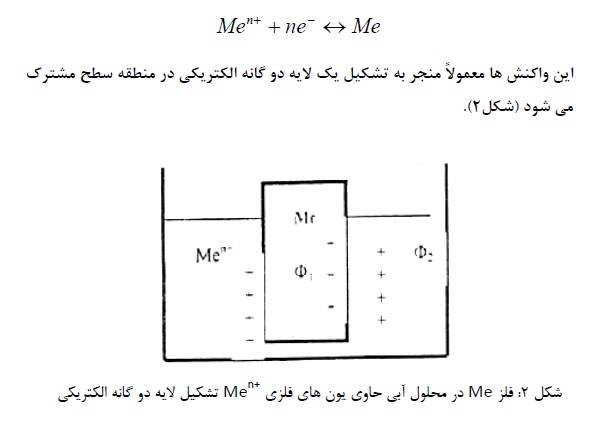
وجود این لایه مضاعف الکتریکی به این معنی است. که اکنون قطعه فلز دارای یک پتانسیل الکتریکی به نام پتانسیل گالوانیکی (1 Φ) در مقابل پتانسیل گالوانیکی محلول (2 Φ) است.
اصول خوردگی
اختلاف پتانسیل گالوانیکی ( 2 Φ) – (Φ 1) را معمولاً با اندازه گیری مستقیم نمی توان تعیین کرد. ولی مقدار نسبی آن را می توان با مقایسه پتانسیل گالوانیکی تفاضلی الکترود مرجع اندازه گرفت.
مکانیزم الکتروشیمیایی
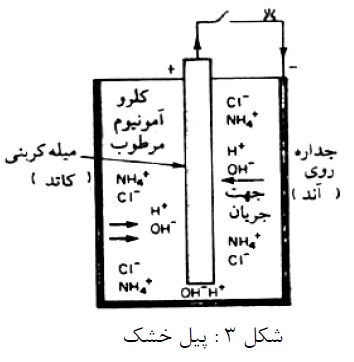
فرآیند خوردگی غالباً الکتروشیمیایی است. عملکرد خوردگی در محیط آبی مشابه مکانیزم یک پیل می باشد. که از یک الکترود ذغال در وسط، بدنه فلز روی و الکترولیت NH4CI متشکل است. نقش گرانول های کربن برای بهبود هدایت و دی اکسید منگنز بعنوان وا قطبی کننده در اینجا مطرح نیست. هنگامی که لامپی به دو قطب پیل وصل شود، روشن میشود و انرژی الکتریکی برای روشن ماندن لامپ توسط واکنش دو الکترود تأمین می گردد. در الکترود ذغالی (قطب مثبت)، احیاء شیمیایی صورت می گیرد. و در الکترود منفی اکسایش شیمیایی صورت میپذیرد و فلز روی به یون روی هیدارته مبدل می گردد.
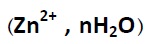
اصول خوردگی
و خواهیم داشت:
KIT=وزن فلز وکنش کننده
K= معادل الکتروشیمیایی (گرم در کولمب)
I= جریان برحسب آمپر
T= زمان بر حسب ثانیه
معادل الکتروشیمیایی یا معادل یک کولمب وزن (گرم) که معادل یک کولمب جریان الکتریسیته می باشد. و از تقسیم وزن هم ارز (گرم=اکی والان گرم) هر عنصر یا بنیان بر حسب گرم بر عدد فارداه بدست می آید.
در مورد فلز روی معادل الکتروشیمیایی برابر4- 10 × 3/39 گرم بر کولن است. اگر دو قطب اتصال کوتاه شوند، ظرف چند ساعت بدنه پیل سوراخ می شود. اگر دو قطب وصل نباشند روی سالها دست نخورده باقی می ماند. و اگر به مقدار کمی مصرف شود مربوط به وجود ناخالص های سطح فلز روی (نظیر آهن) می باشد. که به دلیل تشکیل پیل های موضعی است. که باعث کمی گرما در اطراف خود می شود (شکل 4).
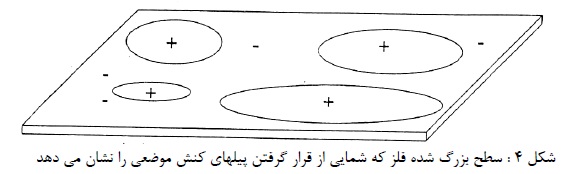
تا زمانی که سطح فلز خشک بماند جریان موضعی و خوردگی ناشی از آن وجود نخواهد داشت. ولی در معرض آب و محلول های آبی این پیل ها شروع به فعالیت نموده. واکنش تبدیل شیمیایی فلز به محصول خوردگی آغاز می گردد. و به عبارت دیگر غالباً عامل خوردگی در آب، قلیایی ها، اسیدها و محلول های نمک می باشند. هرگاه ناخالصی های فلز تشکیل دهنده الکترودهای پیل موضعی باشند، فلز فاقد ناخالصی دارای مقاومت چشم گیر در برابر خوردگی خواهد بود.
آلومینیوم و منیزیم تجارتی در مقایسه با نوع خالص در آب دریا و اسیدها مقاومت کمتری در برابر خوردگی دارند. همین حالت در مورد فلز روی در اسید کلریدریک وجود دارد. ولی همیشه وضعیت به این منوال نیست. انواع دیگری از پیل های خوردگی نیز می توانند در اثر تغییرات محیطی، مانند غلظت یا دما فعال باشند. این نوع پیل ها بعداً مورد بحث قرار خواهند گرفت.
بعنوان مثال هنگامی که در آب پر از هوا قرار می گیرد. الکترود منفی سطوح پوشش می شود، با احتمالاً زنگ متخلخل (اکسید آهن) می باشد. و الکترود مثبت نواحی در معرض اکسیژن الکترودهای مثبت و منفی با پیشرفت واکنش خوردگی با یکدیگر تعویض میشود. تغییر مکان می دهند و بر این روال آهن تجارتی و خالص در آب اشباع شده از هوا با سرعت یکسانی خورده می شوند.
اصول خوردگی
تشکیل پیلها با دو الکترود
دو هادی الکتریکی (الکترود) فرو برده شده در یک الکترولیت پیل گالوانیکی را تشکیل می دهند. اگر دو قطب این پیل توسط یک هادی به همدیگر اتصال کوتاه گردد. از طریق سیم جریان مثبت از قطب مثبت به منفی برقرار می گردد. در یک هادی فلزی جریان توسط حامل های بار منفی صورت می گیرد. و در حقیقت جریان الکتریسیته حرکت الکترون ها در فلز می باشند. طبق قرارداد، مراد از جریان الکتریسیته حرکت جریان مثبت از قطب مثبت به منفی می باشند. هرجایی که از جریان نام برده نشود، منظور بار مثبت می باشد.
در درون الکترولیت جریان توسط دو نوع حامل بار مثبت و منفی برقرار می گردد. یون نامیده می شوند. جریان حمل شده توسط هر یون بستگی به بار الکتریکی و تحرک آن یون دارد. کل جریان مثبت و منفی.الکترودی که در آن اکسایش شیمیایی صورت می گیرد (جریان مثبت از الکترود خارج و به داخل الکترود واد می گردد) آند نامیده می شود.
نمونه های واکنش آندی:
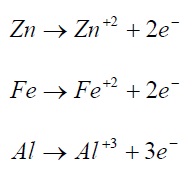
الکترودی که در آن احیاء شیمیایی رخ می دهد (جریان مثبت از الکترولیت به الکترود وارد می شود) کاتد خوانده می شود.
نمونه های واکنش کاتدی:
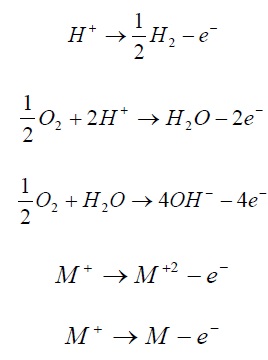
واکنش اکسایش یا آندی افزایش ظرفیت یون و تولید الکترون را در بر دارد. و کاهش ظرفیت یون و مصرف الکترون نشانه واکنش کاتدی یا احیاء می باشد. واکنش های کاتدی و آندی باید همزمان و با یک سرعت در نواحی مربوطه روی سطح فلز انجام شوند. اگر چنین نباشد باید فلز خود به خود باردار گردد. که غیر ممکن است.
و در حقیقت مهمترین اصل در خورندگی برابر بودن سرعت اکسایش با سرعت احیاء می باشد. (از نقطه نظر تولید و مصرف الکترون) ممکن است در یک واکنش خوردگی چند واکنش اکسایش یا احیاء صورت بگیرد. از آنجا که واکنش های اکسایش و احیائی که در حین خوردگی رخ می دهند به هم وابسته می باشند. می توان با کاهش سرعت هر یک از این دو نوع واکنش، خوردگی را کند نمود.
مثلاً اگر سطح فلز با رنگ یا پوششی غیرهادی پوشنده شود. سرعت هر دو واکنش کاتدی و آندی را کاهش می دهد. یا کاهش سرعت واکنش کاتدی یا آندی به کمک افزودن درصد ناچیز ممانعت کننده کاهش می یابد.
انواع پیل
پیل ها از نظر ساختاری به دو دسته 1- پیل های با الکترود غیر مشابه 2- پیل های با الکترود مشابه تقسیم بندی می شوند.
1- پیل الکترودهای غیر مشابه
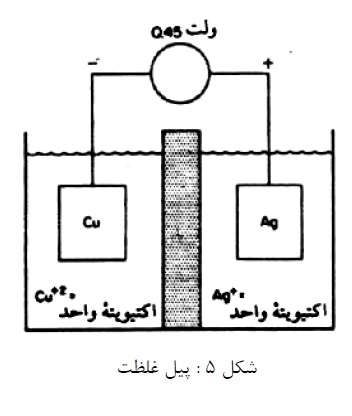
این پیل قبلاً با مثال پیل خشک تشریع شده است. این پیل ها از دو فلز (الکترود) غیر همنام و سیالی به نام الکترولیت تشکیل شده اند. به عنوان مثال، فلزی که بر روی سطح خود دارای ناخالصی های هادی الکتریسیته به صورت فاز جداگانه است. لوله مسی در تماس با لوله آهنی، فلز کار سرد شده در تماس با همان فلز که آنیل شده است. فلز مرزدانه در تماس با فلز خود دانه، یک کریستال در یک جهت آرایش با کریستالی. در آرایش متفاوت همگی نمونه هایی از پیل های غیر مشابه می باشند (شکل 5).
2-پیل الکترودهای مشابه
این پیل ها از دو فلز (الکترود) همنام که دارای تاریخچه یکسان باشند و سیالی به نام الکترولیت تشکیل می شود. منظور از تاریخچه یعنی تمامی عملیاتی که بر روی فلز آند از قبیل ترکیب شیمیایی، روند تولید، عملیات حرارتی. عملیات ماشینکاری و غیره انجام می گیرد، بر روی فاز کاتد نیز انجام گردد. این پیل ها به سه دسته پیل های اختلاف غلظت، پیل های اختلاف دمشی و پیل های اختلاف درجه حرارت تقسیم بندی می شوند.
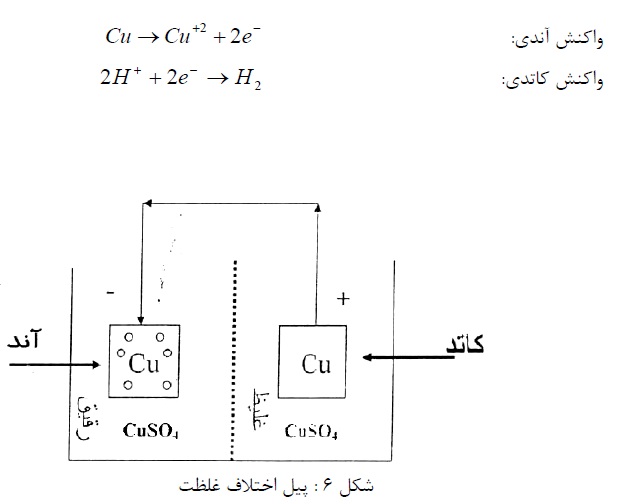
3- این پیل ها دارای دو الکترود مشابه در تماس با محلول های با ترکیب شیمیایی متفاوت می باشند. نمونه ای از پیل اختلاف غلظت، پیل غلظت نمکی می باشد، مانند مس در سولفات مس رقیق (آند) و مس در سولفات مس غلیظ (کاتد). مس در محلول رقیق تر حل و در محلول غلیظ تر را سبب می شود (شکل 6).
واکنش های آندی و کاتدی به شرح ذیل می باشد:
اصول خوردگی
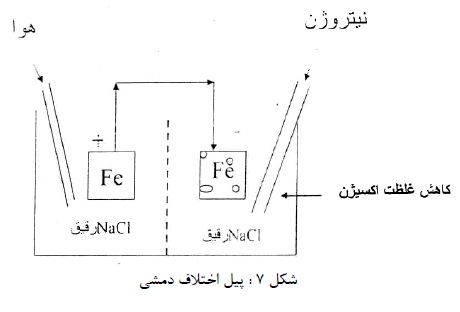
4- پیل های اختلاف دمشی
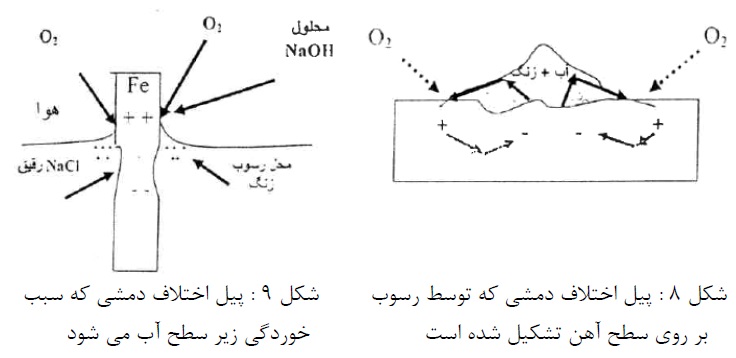
نوع دوم پیل، اختلاف دمشی می باشد و در عمل اهمیت زیادی دارد. این پیل را می توان با دو الکترود آهن در محلول رقیق کلرید سدیم نشان داد که اطراف یک الکترود (کاتد) اشباع از هوا باشد. (با دمیدن هوا در محلول) و اطراف الکترود دیگر (آند) فاقد هوا (با دمیدن نیتروژن در محلول). اختلاف غلظت هوا موجب اختلاف پتانسیل و برقراری جریان می گردد (شکل7).
این پیل در شیارها و زیر رسوبات یا خط سطح آب می تواند موجب خوردگی گردد (شکل های 8 و 9).
در زیر رسوب یا سطح آب غلظت اکسیژن کمتر از قسمت های در معرض هوا می باشد. در مورد فلزات و آلیاژهای روئین در معرض آب دریا این پیل سبب خوردگی خواهد شد.
اصول خوردگی
5- پیل اختلاف دما
اجزاء این پیل الکترودهایی از یک فلز با دمای متفاوت و در الکترولیت با ترکیب شیمیایی اولیه یکسان می باشند. در مورد مبنای تئوری و اهمیت علمی آن اطلاعات کمی وجود دارد و احتملاً در دستگاهایی مانند مبدل های حرارتی. گرم کننده های مغروق، جوشاننده ها و نظیر آنها فعال می باشد. در محلول سولفات مس الکترود مس گرم تر کاتد و الکترود سردتر آند است.
اصول خوردگی
سرب نیز به همین شکل می باشد. ولی قطب ها در مورد نقره عکس است. در مورد آهن در محلول رقیق کلرید سدیم حاوی هوا الکترود گرمتر نسبت به سردتر آند می باشد. و در مدتی حدود چند ساعت بسته به سرعت حرکت محلول و اتصال کوتاه بودن یا نبودن قطب ها معکوس می شوند. در عمل پیل های خوردگی ممکن است تلفیقی از هر سه نوع مورد بررسی باشند.
جداول اکسایش و کاهش
زمانی که یک واکنش الکتروشیمیایی از حالت تعادل خود دچار آشفتگی می گردد. پایداری نسبی نمونه ها در واکنش تغییر می کند. که این تغییر به واسطه آشفتگی، مربوط به پتانسیل الکترود اندازه گیری گردید که با پتانسیل الکترود تعادل واکنش متفاوت است. اگر پتانسیل الکترود مورد اندازه گیری نسبت به پتانسیل الکترود تعادل مثبت باشد. واکنش ذیل بطور برگشت ناپذیر از چب به راست پیش می رود و برعکس.
-ne+ نمونه اکسید شده = نمونه های احیاء شده
دیاگرام های پوربه رابطه بین پتانسیل های الکترود واکنش های الکتروشیمیایی و PH را نشان می دهند. و این دیاگرام ها در تشخیص پایداری نواحی مربوط به نمونه های شیمیایی مختلف در محلول کمک شایانی می نمایند.
با توجه به دیاگرام پوربه H2O می توان پی برد که آب در پتانسیل های بین خطوط a و b پایدار بوده. و در خارج آن ناپایدار می باشد. همچنین مطابق این دیاگرام فلزات از نظر فعالیت به 5 دسته تقسیم می شوند:
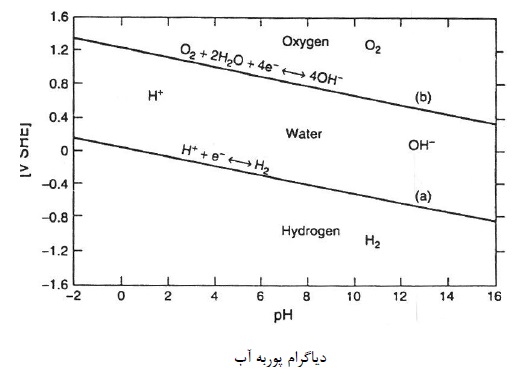
1-فلزات خیلی نجیب
پتانسیل احیای فلزاتی مانند طلا، نقره و پلاتین بسیار بالاتر از پتانسیل احیای آب می باشد. بنابراین، این گونه از فلزات اصلاً نیازی به حفاظت کاتدی ندارند.
2- فلزات نجیب
پتانسیل احیای این فلزات (مانند مس) بین پتانسیل احیای آب و پتانسیل احیای هیدروژن می باشد. بنابراین، این نوع فلزات در محیط های بدون اکسیژن خوردگی پیدا نمی کنند. ولی در محیط های اکسیژن نیاز به حفاظت کاتدی دارند.
3- فلزات فعال
پتانسیل این گونه فلزات (مانند آهن) زیر پتانسیل احیای هیدروژن می باشد. بنابراین، این فلزات در محیط های حاوی اکسیژن در تمام pH ها باید حفاظت شوند. و در محیط های بدون اکسیژن در pH های اسیدی نیاز به حفاظت دارند.
اصول خوردگی
4-فلزات خیلی فعال
پتانسیل این گونه فلزات (همانند آلومینیوم، تیتانیوم) بسیار کمتر از پتانسیل احیای هیدروژن می باشد. بنابراین اینگونه فلزات در هر محیط و در هر pH نیاز به حفاظت خواهند داشت. این فلزات به محض قرار گیری در این گونه محیط ها و به محض نشست لایه اکسید روی آنها رویین می شوند. همچنین جریان خیلی زیادی جهت حفاظت آنها نیاز می باشد.
اصول خوردگی
5-فلزات رویین شونده
این فلزات در محیط ابتدا خوردگی پیدا می کنند. و لایه اکسید تشکیل می گردد و این لایه مانند سپری از خوردگی فلز جلوگیری می کنند. در این حالت لازم نیست که جریان آن قدر وارد شود تا پتانسیل به E0 فلز برسد. بلکه می توان جریان را به اندازه ای تزریق کرد که پتانسیل فلز در محدودۀ پتانسیل رویین شدن قرار گیرد.
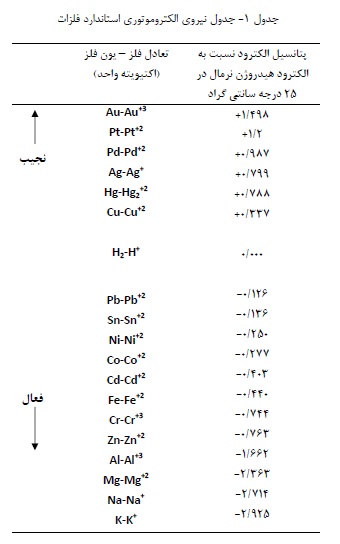
اختلاف پتانسیل بین فلزات تحت شرایط غیر خورنده می تواند اساس پیش بینی تمایل خوردگی بیان شود. بطور خلاصه، پتانسیل بین فلز در تماس با محلول حاوی تقریباً یک اتم گرم یون فلز مربوطه (اکتیویته واحد). در یک درجه حرارت ثابت به دقت اندازه گیری می شود. جدول 1، که غالباً جدل نیروی الکتروموتوری یا جدول emf نام دارد. طرز قرار گیری فلزات مختلف را نسبت به یکدیگر نشان می دهد. برای سادگی کلیه پتانسیل ها را نسبت به یک الکترود مرجع +H2 / H که بطور دلخواه صفر فرض می شود می سنجند.
پتانسیل بین فلزات مختلف را با گرفتن اختلاف بین پتانسیل استاندارد emf آنها حساب می کنند. مثلاً اختلاف پتانسیل بین الکترودهای مس و نقره 0/462 ولت است. اختلاف پتانسیل بین مس و روی 1/1 ولت است. برای آلیاژهایی که از دو یا چند جزء فعال تشکیل می شوند. بدست آوردی پتانسیل آزاد عملی نیست. لذا در جدول 1 فقط فلزات خالص وجود دارند.
در مسائل عملی خوردگی، تماس گالوانیکی بین فلزات در حال تعادل با یونهای خود بندرت اتفاق می افتد. همانطور که در بالا ملاحظه شد قسمت اعظم اثرات خوردگی گالوانیکی در اثر ارتباط الکتریکی دو فلز است. که هر کدام به تنهایی قبل از اتصال الکتریکی با یکدیگر نیز در حال خورده شدن هستند. همچنین چون اکثر مواد مهندسی را آلیاژها تشکیل می دهند.
اصول خوردگی
بنابراین اتصال گالوانیکی معمولاً مشتمل بر یک (یا دو) آلیاژ فلزی می باشد. این شرایط جدول گالوانیکی، جدول 2 پیش بینی دقیق تری از روابط گالوانیکی می کند تا جدول emf. جدول 2 بر اساس اندازه گیری های پتانسیل و آزمایشات خوردگی گالوانیکی در آب دریا آلوده نشده می باشد. که بوسیله شرکت بین المللی اینکو انجام شده است. بخاطر اختلاف بین آزمایشات مختلف، تنها موقعیت نسبی فلزات در این جدول مشخص شده است. نه پتانسیل آنها. در حالت ایده آل، جداول مشابهی برای فلزات و آلیاژها در تمام محیط ها در درجه حرارت های مختلف مورد نیاز خواهد بود. لکن در این صورت تقریباً بی نهایت آزمایش بایستی انجام شود.
بطور کلی موقعیت فلزات و آلیاژها در جدول گالوانیکی به نحو مناسبی با موقعیت فلزات تشکیل دهنده آنها در جدول emf تطابق دارد. غیر فعال شدن (روئین شدن) بر رفتار خوردگی گالوانیکی اثر می گذارد. توجه کنید در جدول 2 فولاد زنگ نزن در حالت غیر فعال در موقعیت نجیب تری قرار داد. نسبت به موقعی که این آلیاژها در حالت فعال قرار دارند. رفتار مشابهی بوسیله اینکونل که یک نیکل زنگ نزن است مشاهده می شود.
اصول خوردگی
یک ویژگی جالب توجه دیگر جدول گالوانیکی کروشه هایی است که در جدول 2 نمایان می باشد. آلیاژهایی که در این کروشه ها جمع هستند. تا اندازه ای از نظر ترکیب اصلی مشابه هستند. مثلاً، مس و آلیاژهای مس، کروشه ها نشان می دهند. که در اثر کاربردهای عملی خطر کمی برای خوردگی گالوانیکی زوج های فلزات و آلیاژهایی. که در یک کروشه خاص قرار دارند، وجود دارند. این بخاطر نزدیکی این ها به یکدیگر در جدول می باشد. و در نتیجه پتانسیل بوجود آمده بین آنها چندان قابل توجه نخواهد بود. در این جدول نیز هرچه دو فلز از یکدیگر دورتر باشند. اختلاف پتانسیل بین آنها بیشتر خواهد بود.

در صورت عدم وجود نتایج آزمایشات در یک محیط خاص، سری گالوانیکی راهنمای خوبی برای اثبات احتمالی گالوانیکی می باشد. بعنوان مثال چند مورد انهدام را با استفاده از جدول 2- بررسی می کنیم. یک بنده قایق از جنس مونل با میخ پرچ های فولادی در اثر خوردگی سریع میخ پرچ های فولادی سوراخ شد. لوله های آلومینیوم متصل به لوله های برگشتی برنجی بشدت دارای خوردگی شدند. تانکهای آب گرم منازل از جنس فولاد در محل اتصال لوله های مسی به تانک سوراخ می شوند. شفت پمپ ها یا تیغه های والوها از جنس فولاد یا مواد مقاومتر در مقابل خوردگی، در اثر تماس با گرافیت خوردگی پیدا می کنند.
خوردگی گالوانیکی گاهی اوقات در محل های غیر منتظره ای اتفاق می افتد. مثلاً در یک مورد، خوردگی در لبه های جلوی مدخل ورودی محفظه موتورهای چت اتفاق افتاد. خوردگی در اثر پارچه ای که روی مدخل ورودی موتور قرار داشت، اتفاق افتاد. برای جلوگیری از رشد قارچ و جلبک روی این پارچه، آنرا با نمک های مس آمیخته کرده بودند. آمیختگی پارچه با نمک های مس برای جلوگیری از رشد قارچ و جلبک، ضد آتش کردن و دلایل دیگر خیلی متداول است. نمک مس باعث راسب شدگی مس روی فولاد آلیاژی میشود و در نتیجه فولاد بطور گالوانیکی دچار خوردگی می شود. این مسئله با استفاده از یک نایلون یا پوشش وینیلی که حاوی هیچگونه فلزی نباشد، قابل پیشگیری می باشد.
این مثالها بر این واقعیت تأکید می کنند که مهندس طراح بایستی مخصوصاً از اثرات خوردگی گالوانیکی آگاه باشد. گاهی اوقات کاربرد فلزات همجنس در تماس با یکدیگر اقتصادی است. مثلاً دیگ بخار (بویلر) با لوله های مسی و صفحه لوله چدنی یا فولادی در تماس است. در صورت وقوع خوردگی گالوانیکی، صفحه لوله ها که ضخیم و حجیم است دچار خوردگی خواهد شد. (در مقایسه با لوله های نازک مسی)، و بخار ضخامت زیاد صفحه لوله ها، عمر آنها زیاد خواهد بود.
اصول خوردگی
همچنین در عین حال به جای صفحه لوله های برنزی گرانقیمت از صفحات چدنی یا فولادی که ارزانتر هستند، استفاده شده است. در شرایطی که از نظر خوردگی شدیدتر است. مثلاً در محلول های رقیق اسیدی یا در مواردی که کمترین سرعت خوردگی باعث آلودگی و در نتیجه خساراتی به سیستم خواهد بود. ممکن است صفحه لوله ها را از جنس برنز انتخاب کنند.
پتانسیل تولیدی بوسیله یک پیل گالوانیکی که از دو فلز غیر همجنس ساخته شده است. با زمان تغییر می کند. اختلاف پتانسیل باعث جریان میشود و خوردگی در الکترود آندی اتفاق می افتد. با پیشرفت خوردگی، محصولات حاصل از خوردگی یا واکنش های دیگر ممکن است. روی سطح آند یا کاتد یا هر دو تجمع نمایند و بدین ترتیب سرعت خوردگی تقلیل یابد.
در خوردگی گالوانیکی، معمولاً پلاریزاسیون واکنش احیا (پلاریزاسیون کاتدی) کنترل کننده است. چون درجه پلاریزاسیون و مؤثر بودن آن بستگی به فلز آلیاژ دارد. لذا قبل از آنکه بتوان میزان خوردگی گالوانیکی را برای یک کوپل پیش بینی نمود. لازم است اطلاعاتی درباره ویژگی پلاریزاسیون آنها بدست آورد. مثلاً تیتانیم در آب دریا خیلی نجیب می باشد (مقاومت عالی نشان می دهد). معهذا خوردگی گالوانیکی یک فلز فعالتر که در تماس با تیتانیم در آب دریا قرار می گیرد. معمولاً شدید نخواهیم بود یا کمتر از مقداریست که پیش بینی می شود. دلیل آن این است که تیتانیم به سهولت در آب دریا بصورت کاتدی پلاریزه می شود.
اصول خوردگی
بطور خلاصه جدول سری گالوانیکی ویژگی های خوردگی گالوانیکی را دقیق تر از جدول emf نشان می دهد. لکن همانطور که بعداً بحث خواهد شد بایستی توجه داشت که در مورد سری گالوانیکی نیز استثنائاتی وجود دارد. لذا هرجا که ممکن باشد بایستی آزمایشات خوردگی در شرایط مورد نظر انجام شود.
5-الکترود مرجع
اگرچه معمولاً برای هر واکنشی میتوان پیل الکتروشیمیایی خوردگی ایجاد نمود. ولی تعداد بینهایت واکنش وجود خواهد داشت که هر اندازه گیری و هم جدول بندی این گونه نتایج غیر ممکن خواهد بود. برای سادگی جدول بندی و محاسبات پتانسیل های پیلها، نظریه پتانسیل نیم پیل ها توسعه پیدا کرده است. پتانسیل یک واکنش نیم پیل انتخابی صفر فرض می شود. و بعنوان مرجع بکار می رود و تمام پتانسیل های نیم پیل های دیگر نسبت به این مرجع صفر محاسبه می شوند. اگرچه برای این نقطه مرجع، هر واکنش نیم پیل را می توان بکار برد، ولی واکنش هیدروژن – یون هیدروژن
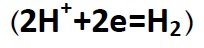
مورد قبول همه می باشد، چون به سهولت می توان یک الکترود نیم پیل ساخت. مثلاً واکنش بین روی و هیدروژن را در نظر بگیرید:

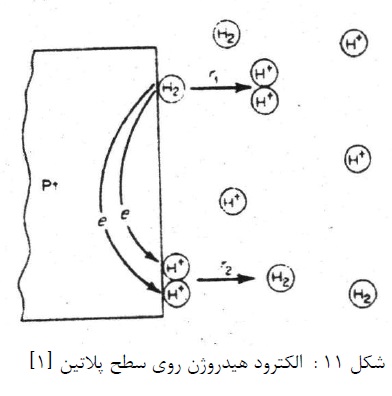
چون امکان ساخت یک الکترود از گاز هیدروژن وجود ندارد، از یک الکترود خنثی استفاده می شود. در شکل 10 نیم پیل های روی و پلاتین نمایان و مشخص است. همانطور که در شکل 111 ملاحظه می شود الکترود پلاتین بعنوان یک سطح خنثی برای واکنش الکتروشیمیایی عمل می کند. در نقاط مختلف سطح الکترود پایین، یون های هیدروژن به گاز هیدروژن احیاء می شوند. و گاز هیدروژن به یون ها هیدروژن اکسید می شود و انتقال الکترون بین این دو نقطه صورت می گیرد. توجه شود که الکترود پلاتین در این واکنش شرکت نمی کند بلکه فقط به عنوان یک سطح خنثی برای واکنش الکتروشیمیایی عمل می کند. برای ساخت الکترود نیم پیل هیدروژن از فلزات زیادی می توان استفاده کرد. ولی پلاتین بخاطر خنثی بودن و سهولت انتقال الکترون روی سطح آن ارجح تر است.
اصول خوردگی
همانطور که در مورد نیم پیل های دیگر نیز اشاره شد غلظت یون های هیدروژن را در اکتیویته واحد می گیرند. و محلول را با گاز هیدروژن با فشار یک اتمسفر اشباع می کنند.
پیل نشان داده شده در شکل 10 دارای پتانسیل 0/763 ولت است و الکترود روی نسبت به هیدروژن منفی خواهد بود.
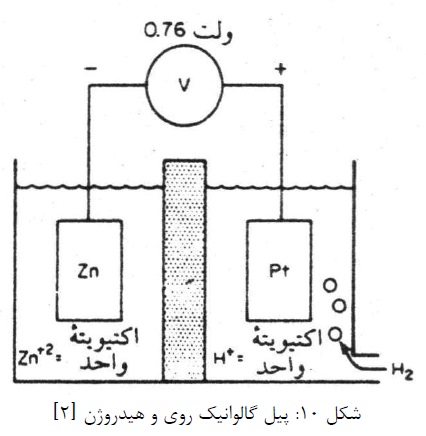
با استفاده از قرارداد فوق، پتانسیل الکترود هیدروژن صفر فرض می شود و در نتیجه پتانسیل نیم پیل روی 0/76 – ولت خواهد شد. پتانسیل نیم پیل های دیگر را به همین روش می توان محاسبه کرد. در جدول 3 پتانسیل نیم پیل های بعضی واکنش های الکتروشیمیایی نشان داده شده است. این جدول غالباً جدول نیروی الکتروموتوری، پتانسیل نیم پیل یا پتانسیل اکسیداسیون – احیاء نامیده می شود. پتانسیل اکسیداسیون -احیاء را غالباً بطور خلاصه پتانسیل ردوکس می نامند. توجه شود که در تمام موارد این پتانسیل ها مربوط به الکترودهایی در اکتیویته واحد و در 25 درجه سانتی گراد می باشند.
اصول خوردگی
با استفاده از اطلاعات جدول 3 می توان پتانسیل پیل واکنش های الکتروشیمیایی مختلف را محاسبه نمود. توجه شود که قدر مطلق اختلاف پتانسیل بین الکترود مس و الکترود روی تقریباً 1/1 ولت است. و الکترود مس نسبت به روی مثبت است به همین ترتیب اختلاف پتانسیل بین الکترود مس و نقره 0/45 ولت است. و مس نسبت به نقره منفی است. بدین ترتیب استفاده از پتانسیل های ردوکس محاسبه پتانسیل پیل ها را خیلی آسان می کند.
جدول 3- پتانسیل های استاندارد اکسیداسیون – احیا در دمای 25 درجه سانتی گراد

برای تعیین پتانسیل یک سیستم که در آن مواد شرکت کننده در واکنش در اکتیویته واحد قرار ندارد، از معادله نرنست می توان استفاده کرد.
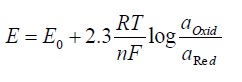
در این رابطه E پتانسیل پیل، E پتانسیل استاندارد پیل. R ثابت گازها، a Oxid و a Red اکتیویته های اجزاء که اکسید هستند. و احیاء شده می باشند. با توجه به معادله بالا با افزایش مقدار جزء اکسید شونده، پتانسیل نیم پیل مثبت تر می شود. در یک واکنش که تک الکترونی باشد. به ازای هر 10 برابر شدن مقدار جزء اکسید شونده، پتانسیل نیم پیل 59 میلی ولت افزایش می یابد.
6- تشریح واکنشهای الکتروشیمیایی
طبیعت الکتروشیمیایی خوردگی را می توان با خورده شدن فلز بوسیله اسید کلریدریک نشان داد. موقعی که یک قطعه روی را داخل اسید کلریدریک وارد می کنیم. واکنش سریع و مداومی اتفاق می افتد. گاز هیدروژن که آزاد است و روی وارد محلول می شود و تشکیل محلول کلرور می دهند. واکنش انجامی به شکل زیر است:
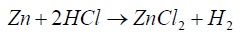
با توجه به اینکه یون کلر در واکنش دخالتی ندارد. این معادله را بصورت زیر می توان نوشت:
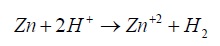
بدین ترتیب، روی با یون های هیدروژن اسید ترکیب میشود و تشکیل یون های روی و گاز هیدروژن می دهد. در طی این واکنش، روی اکسید شده و تبدیل به یون های روی می شود. و یون های هیدروژن با گرفتن الکترون هایی که آزاد هستند. توسط روی احیاء شده و تبدیل به هیدروژن شده اند. بدین ترتیب معدله بالا را می توان بسادگی به دو واکنش، اکسیداسیون روی و احیاء یونهای هیدروژن تقسیم نمود.

در واکنش اکسیداسیون ظرفیت افزایش می یابد یا بعبارت دیگر الکترون تولید می شود. در صورتی که در واکنش احیائ ظرفیت کم می شود. یا الکترون مصرف می شود. واکنش کاتدی فوق جزو واکنش های جزئی بوده و هر دو بایستی در یک زمان و با سرعت یکسان روی سطح فلز اتفاق بیافتد. در غیر اینصورت، فلز بطور ناگهانی دارای بار الکتریکی خواهد شد، که غیر ممکن است. این یکی از مهمترین اصول خوردگی است. در مرحله خوردگی فلزات، سرعت اکسیداسیون مساوی سرعت احیاء است. (از نقطه نظر تولید و مصرف الکترون).
مسئله فوق در شکل 12 نشان داده شده است. در اینجا یک اتم روی تبدیل به یون روی و دو الکترون شده است. این الکترون ها که در فلز باقی می مانند، در واکنش احیائ یونهای هیدروژن به سرعت مصرف می شوند. در شکل 12 این دو واکنش بخاطر واضح تر بودنشان، جدا از هم نمایش یافتند. این مسئله که آنها عملاً در یک نقطه اتفاق می افتند، یا خیر، اصل بقاء الکتریکی را نقض نمی کند. در بعضی حالات، واکنش اکسیداسیون بطور یکنواخت روی سطح فلز واقع می شود. در حالی که در برخی موارد دیگر موضعی بوده و در نواحی خاصی اتفاق می افتند.
تا این اواخر تئوری خوردگی معمولاً بر اساس مفهوم نواحی موضعی آندی و کاتدی موجود در سطح استوار بوده است. لکن بیان پدیده خوردگی بر اساس اصول مدرن سینتیک الکترود (تئوری پتانسیل فلز مختلف) حالت عمومی تری دارد. زیرا این تئوری قابل کاربرد به انواع سیستم های خورنده ندارد.
قابل ذکر است که این دو روش تجربه و تحلیل پدیده خوردگی با یکدیگر مغایرت نداشته و تنها نشان دهنده. دو نوع روش مختلف برای نزدیک شدن به مسأله می باشند. در این جزوه بواسطه سادگی و عمومی تر کاربرد از مفهوم سینتیک الکترود استفاده می گردد.
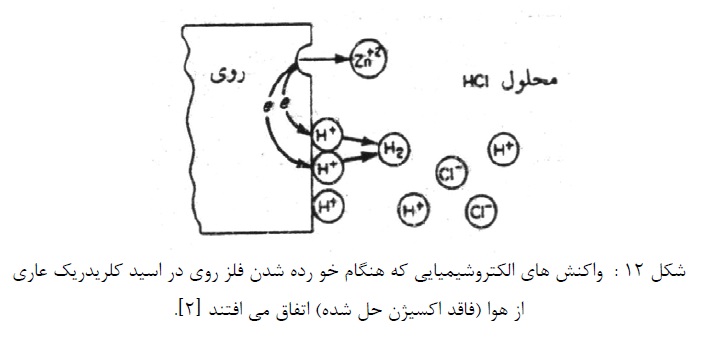
خوردگی روی در اسید کلریدریک یک فرآیند الکتروشیمیایی است. هر واکنش را که بتوان تقسیم به دو یا چند واکنش جزئی اکسیداسیون و احیاء نمود، واکنش الکتروشیمیایی می نامند. تقسیم واکنش های الکتروشیمیایی خوردگی به واکنش های جزئی، مطالعه آنها را آسان تر می کند. آهن و آلومینیوم نیز بوسیله اسید کلریدریک بسرعت خورده می شوند و واکنش های خوردگی آنها عبارتند از:
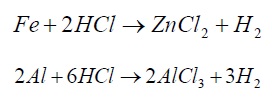
اگرچه در اولین نگاه این واکنش ها کاملاً مختلف بنظر می رسند. مقایسه واکنش های جزئی اکسیداسیون و احیائ نشان می دهد که واکنش روی در محلول اکسید کلریدریک با واکنش های فوق کاملاً مشابه یکدیگر هستند. تمام این واکش ها مشتمل بر احیاء یون هیدروژن بوده و تنها واکنش های آندی یا اکسیداسیون آنها با یکدیگر فرق دارد.
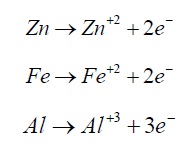
بدین ترتیب مسئله چگونگی خورندگی اسید کلریدریک، حل می شود. زیرا در هر مورد واکنش کاتدی آزاد شدن گاز هیدروژن است. این مطلب در مورد خورندگی اسیدهای دیگر مثل اسید سولفوریک، فسفریک، فلوریدریک و اسیدهای آلی محلول در آب. مثل اسید فرمیک و اسید استیک نیز صادق است. در هر مورد، تنها یون هیدروژن عامل فعال است و یون های دیگر مثل سولفات، فسفات و استات در واکنش الکتروشیمیایی شرکت نمی کنند.
هنگامی که از نقطه نظر واکنش های جزئی اکسیداسیون و احیاء مسئله را در نظر بگیریم. کلیه انواع خوردگی را می توان در تعداد معدودی از واکنش های عمومی خلاصه نمود. واکنش آندی در هر فرآیند خوردگی، اکسیداسیون فلز به یون های آن می باشد. این مطلب را بصورت کلی زیر می توان نوشت.
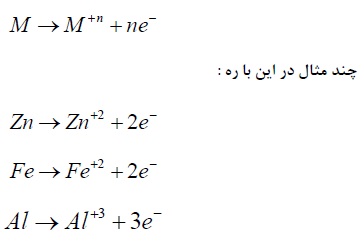
در هر مورد تعداد الکترون های تولید شده مساوی با ظرفیت یون می باشد. در خوردگی فلزات چند نوع واکنش کاتدی مختلف وجود دارد که غالباً بصورت یک یا چند تا از واکنش های زیر می تواند اتفاق بیافتد:

آزاد شدن هیدروژن یک واکنش کاتدی متداول است زیرا محلول های اسید یا اسیدی در عمل فراوانند. احیاء اکسیژن نیز خیلی معمولی است زیرا هر محلول آبی که در تماس با هوا باشد قادر خواهد بود این واکنش را انجام دهد. احیاء یون فلزی یا راسب شدن فلز، واکنش های نادرتری بوده و بیشتر در مسیرهای فرآیندهای شیمیایی اتفاق می افتد. تمام این واکنش ها کاملاً مشابه هستند-تمام آنها الکترون مصرف می کنند.
اصول-خوردگی
واکنش های جزئی فوق را می توان برای تفسیر تقریباً تمام مسائل خوردگی بکار برد. مثلاً وقتی که آهن را درون آب یا آبی که در تماس با اتمسفر قرار دارد. فرو ببریم خوردگی واقع می شود (مثال عملی در این مورد. زنگ زدگی بدنه اتومبیل در اثر رطوبت هوا، یا زنگ زدگی یک ستون فولادی در آب دریا می باشد). واکنش های آندی عبارت است از:
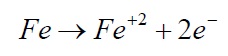
چون محیط مورد نظر در تماس با اتمسفر قرار دارد بنابراین حاوی اکسیژن حل شده می باشد. آب و آب دریا تقریباً خنثی هستند و بدین ترتیب واکنش کاتدی عبارت خواهد بود از:
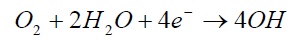
با توجه به این که یون هاهی سدیم و کلر در واکنش شرکت نمی کنند، واکنش کلی از جمع دو واکنش فوق بدست می آید:
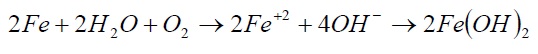
رسوبات هیدروکسید فرو از محلول جدا می شوند لکن این ترکیب در محلول های اکسیژن دار ناپایدار بوده و هیدروکسید فریک اکسید می شود.
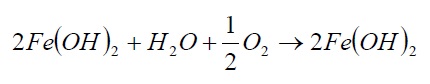
محصول نهایی همان زنگ معروف آهن است.
مثال کلاسیک واکنش های جابجایی، واکنش روی با محلول سولفات مس، راسب شدن فلز را نشان می دهد.

ابتدا روی به وسیله لایه از مس پوشش می گردند و در نهایت جرم متخلخلی از مس و محلول سولفات روی خواهیم داشت.
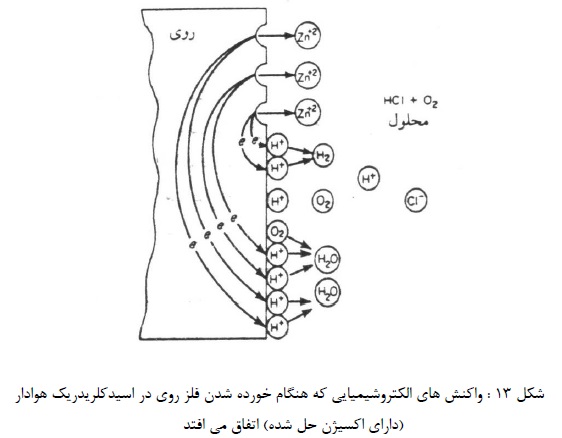
هنگام خوردگی ممکن است بیشتر از یک واکنش اکسیداسیون و احیاء صورت بگیرد. هنگام خوردگی یک آلیاژ، فلزات تشکیل دهنده آن بصورت یون های خود به داخل محلول می روند. زمانی موضوع اهمیت بیشتری پیدا می کند که بیش از یک واکنش احیاء انجام می پذیرد. مثلاً وضعیتی را در نظر بگیرید که در آن روی در اسید کلریدریک هوادار خورده می شود. در این حالت دو واکنش کاتدی امکان پذیر است. آزاد شدن هیدروژن و احیاء اکسیژن، این مسئله در شکل 13 نشان داده شده است.
روی سطح فلز روی دو واکنش مصرف کننده الکترون وجود دارد. چون سرعت های اکسیداسیون و احیاء بایستی مساوی باشند. افزایش کل سرعت احیاء، باعث افزایش سرعت حل شدن روی در محلول می گردد. بنابراین محلول های اسیدی حاوی اکسیژن حل شده، خورنده تر از اسیدهای عاری از اکسیژن می باشند. احیاء اکسیژن یک وسیله دیگر مصرف الکترون را آماده می سازد.
اگر عوامل اکسید کننده دیگری نیز در محلول های اسیدی وجود داشته باشند، حالت مشابهی بوجود می آید. یک ناخالصی که در اسید کلریدریک صنعتی تقریباً همیشه وجود دارد. یون فریک بصورت کلروفریک می باشد. در چنین اسید صنعتی، فلزات خیلی سریعتر خورده می شوند. زیرا در این حالت نیز دو واکنش کاتدی وجود دارد. آزاد شدن هیدروژن و احیاء یون فریک:
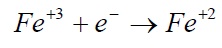
وابستگی واکنش های آندی و کاتدی به یکدیگر، می توان با تقلیل سرعت هر یک از این واکنش ها، سرعت خوردگی را کاهش داد. در مورد فوق که اسید ناخالص وجود دارد. اگر یون های فریک آنها حذف نمایی. کل مقدار واکنش های کاتدی کم می شود. با قطع ارتباط هوا با محلول های آبی یا حذف هوایی که در آن حل شده، واکنش احیاء اکسیژن نیز حذف می گردد. اگر آب دریا بدون اکسیژن داشته باشیم. آهن در آن خوردگی پیدا نمی کند. زیرا در این حالت واکنش کاتدی وجود ندارد.
اصول خوردگی
هنگامی که سطح یک فلز را با رنگ یا پوسته های عایق دیگر می پوشانیم. سرعت واکنش های کاتدی و آندی هر دو تقلیل می یابند و خوردگی متوقف می گردد. ممانعت کننده های خوردگی موادی هستند که وقتی مقدار کم از آنها را به محلول خورنده اضافه نماییم. خورندگی آن محلول کم می شود. طرز عمل ممانعت کننده های خوردگ ایجاد اختلال در واکنش های کاتدی یا آندی، یا هر دو می باشد. اکثر این ممانعت کننده ها ترکیبات آلی هستند و طرز عمل آنها تشکیل پوسته نازک. و نفوذ ناپذیری روی سطح فلز یا ایجاد اختلال در یکی از واکنش های کاتدی یا آندی می باشد.
آمین هایی که جرم مولکولی بالایی دارند مانع از واکنش آزاد شدن هیدروژن می شوند و در نتیجه سرعت خوردگی کاهش می یابد. واضح است که خوردگی یک فلز مستلزم هدایت الکتریکی بالا در فلز و الکترولیت مربوطه است. البته افزایش مقاوت فلز عملی نیست زیرا وقتی که نقاط آندی و کاتدی روی یک سطح قرار دارند. محل آنها کاملاً مشخص نیست و همچنین قابل پیش بینی هم نیستند. ولی می توان مقاومت الکتریکی الکترولیت یا محیط خورنده را افزایش داد و بدین ترتیب سرعت خوردگی را کم نمود. آب خیلی خالص خورندگی خیلی کمتری نسبت به آبهای ناخالص یا آبهای طبیعی دارد. علت این امر بالا بودن مقاومت الکتریکی آب خیلی خالص می باشد.
اصول خوردگی
پلاریزاسیون غلظتی و فعالیتی
بدلیل اهمیت پلاریزاسیون در درک رفتار خوردگی و واکنش های آن، در اینجا مسئله پلاریزاسیون بطور مختصر بحث می شود.
سرعت یک واکنش الکتروشیمیایی بوسیله فاکتورهای شیمیایی و فیزیکی مختلفی کنترل می شود. بدین ترتیب بیان می شود واکنش الکتروشیمیایی در اثر فاکتورهای محیطی پلاریزه یا مختل شدند. دو نوع پلاریزاسیون، یعنی پلاریزاسیون اکتیواسیون و پلاریزاسیون غلظتی را در اینجا مورد بحث قرار می دهیم.
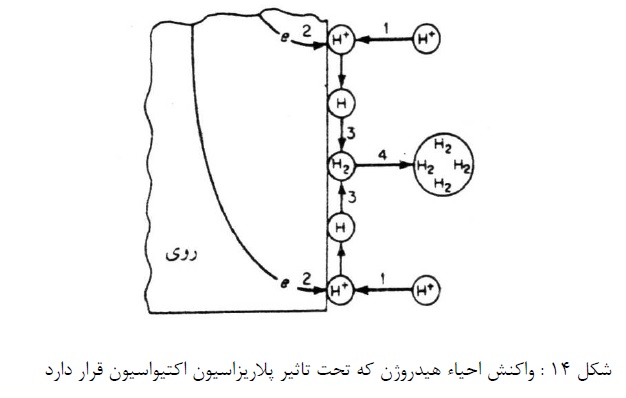
پلاریزاسیون اکتیواسیون به یک واکنش الکتروشیمیایی که بوسیله ترتیب مراحل مختلف واکنش در فصل مشترک فلز-الکترولیت کنترل می گردد، اطلاق می شود. این مطلب را بسادگی می توان با در نظر گیری اتفاقاتی که در واکنش آزاد شدن هیدروژن روی سطح فلز روی. در حین خوردگی در اسید اتفاق می افتد، نشان داد.
در شکل 14 بطور شماتیک مراحل مختلفی که احیا هیدروژن روی سطح روی می تواند طی کند، معلوم و مشخص و نمایان است. این مراحل همچنین می توانند در حین احیاء هر یونی بر روی سطح فلز، انجام شوند. قبل از آن که واکنش بتواند انجام شود یون های هیدروژن بایستی جذب سطح بشوند یا به سطح متصل شوند (مرحله 1). بعد از این مرحله، انتقال الکترون (مرحله 2) بایستی اتفاق بیافتد. در این مرحله یون هیدروژن احیا می شود.
سپس بایستی دو اتم هیدروژن با همدیگر ترکیب شوند و تشکیل مولکول هیدروژن را بدهند (مرحله 3). مرحله بعدی، تجمع مولکول های هیدروژن برای تشکیل حبابت هیدروژن (مرحله 4) می باشد. سرعت احیاء یون های هیدروژن بوسیله کندترین مرحله کنترل می گردد. مکانیزم های مختلفی برای احیاء هیدروژن پیشنهاد گردید. که اکثر آنها پیچیده تر از تصویر فوق الذکر هستند.
اصول خوردگی
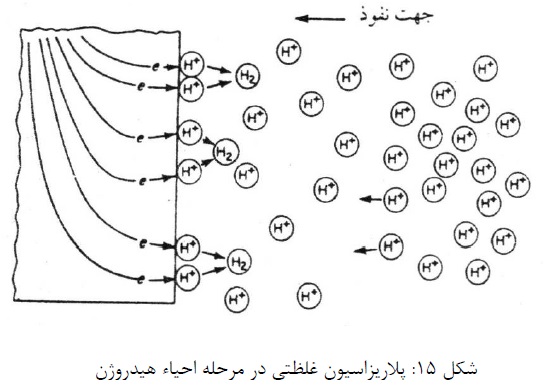
پلاریزاسیون غلظتی به واکنش های الکتروشیمیایی که بوسیله نفوذ یا دیفوزیون در الکترولیت کنترل می شود، اطلاق می گردد. این مسئله در شکل 15 در مورد واکنش آزاد شدن هیدروژن مشخص است. در اینجا مقدار یون های هیدروژن در محلول کاملاً پایین است، و سرعت واکنش بوسیله دیفوزیون هیدروژن به سطح فلز کنترل می گردد.
توجه کنید که در این مورد سرعت احیاء بیشتر بوسیله اتفاقاتی که در داخل محلول اتفاق می افتد، کنترل می گردد. تا بوسیله فعل و انفعالاتی که در سط واقع می شوند. پلاریزاسیون اکتیواسیون معمولاً در خوردگی در محیطی که شامل غلظت بالایی از یون های فعال است (مثل اسیدهای غلیظ) واقع می شود. پلاریزاسیون غلظتی موقعی کنترل کننده است که غلظت یونهای احیاء شونده پایین باشد.
(مثلاً اسیدهای رقیق، محلول های نمکی اکسیژن دار). در اکثر موارد پلاریزاسیون غلظتی در مرحله حل شدن در داخل محلول. (واکنش های اکسیداسیون) معمولاً کم بوده. و می توان از آن صرف نظر کرد، پلاریزاسیون غلظتی تنها در واکنش های احیاء اهمیت دارد. تشخیص بین پلاریزاسیون و پلاریزاسیون غلظتی از اهمیت زیادی برخوردار است.
اصول خوردگی
بر حسب نوع پلاریزاسیونی که واکنش احیاء را کنترل می کند، متغیرهای محیط اثرات مختلفی می توانند داشته باشند. مثلاً هر نوع تغییری در سیستم که سرعت دیفوزیون را افزایش داده اثرات پلاریزاسیون غلظتی را از بین خواهد برد. و در نتیجه سرعت خوردگی افزایش خواهد یافت. بنابراین، موقعی که واکنش کاتدی بوسیله پلاریزاسیون غلظتی کنترل می شود. اضافه کردن سرعت یا تلاطم محیط خورنده باعث افزایش سرعت خوردگی خواهد گردید. اگرچه هر دوی واکنش های آندی و کاتدی بوسیله پلاریزاسیون اکتیواسیون کنترل می شوند.تلاطم محیط خورنده، تأثیری بر سرعت خوردگی نخواهد داشت.
جمع بندی و نتیجه گیری
فرآیند خوردگی غالباً الکتروشیمیایی بوده حاصل انجام هم زمان واکنش های آندی (اکسایش) و احیای کاتدی (کاهش) روی سطح فلز است. این واکنش های الکتروشیمیایی در محل آندها و کاتدهای میکروسکوپی که تمام سطح آهن را پوشش نداده اند رخ می دهند. با توجه به آنچه گفته شد می توان نتیجه گرفت که عملکرد خوردگی که در محیط آبی مشابه مکانیزم یک پیل می باشد. بطور کلی برای تشکیل یک پیل الکتروشیمیایی خوردگی به چهار عامل زیر نیازمند می باشیم:
1- آند : جایی که واکنش نیم پیل آندی انجام شود (اکسایش)
2- کاتد: جایی که واکنش نیم پیل کاتدی انجام می شود (کاهش)
3- الکترولیت: رسانا برای جابجایی یونها (جریان یونی)
4- اتصال الکتریکی: بین آند، کاتد و الکترولیت.
اصول-خوردگی
با توجه به پارامترهای ترمودینامیکی می توان امکان انجام واکنش های آندی و کاتدی و در نتیجه امکان انجام خوردگی را ارزیابی کرد. بدیهی است تحت شرایطی که از نظر پارامترهای ترمودینامیکی. امکان انجام واکنش های آندی و یا کاتدی وجود نداشته باشد خوردگی نخواهیم داشت. پس با کنترل واکنش های آندی یا کاتدی در هر سیستم خوردگی می توان از ایجاد خوردگی جلوگیری کرد.
گروه پژوهشی و صنعتی پارسیان فن یاران
برای پیدا کردن مکان فعالیت استیل دی بر روی کلمه (نقشه) کلید نمایید
استیل دی –Steel day
02166396590– 09922704358
آدرس دفتر مرکزی: تهران – جاده قدیم کرج – بعد از کارخانه شیرپاستوریزه – فتح سیزدهم – مجتمع پایتخت- واحد C9
ارتباط با ما در شبکه های اجتماعی (با کلیک بر روی لینک های زیر به ما بپیوندید)
https://t.me/steel_day تلگرام
https://www.instagram.com/steel_day.ir اینستاگرام
https://twitter.com/MDlakan توییتر

